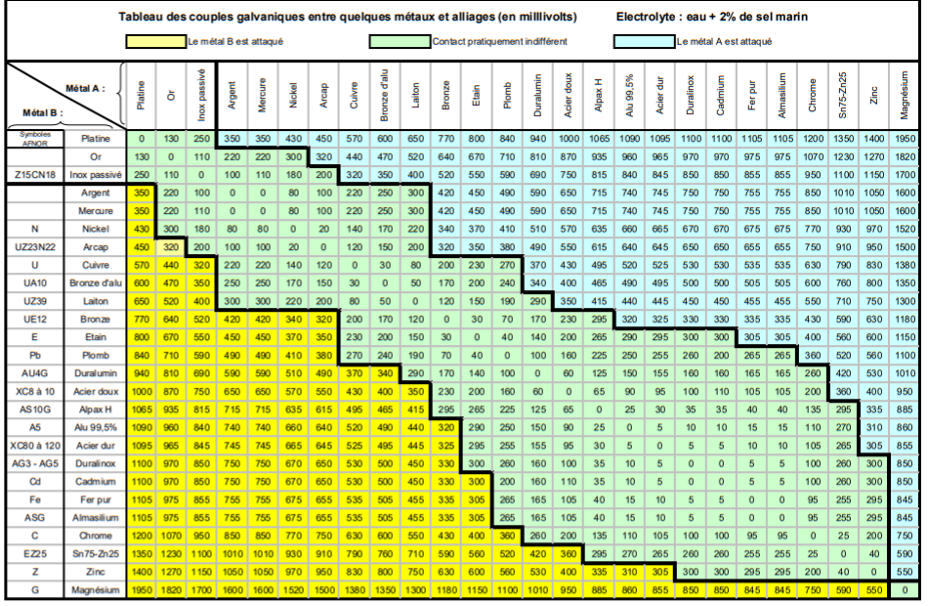
La corrosion galvanique peut se définir simplement par l’effet résultant du contact de deux métaux ou alliages différents dans un environnement corrosif conducteur. On utilise aussi le terme de bimétallisme.
Dans chaque solution, il est possible d’établir une « série galvanique », c’est-à-dire un classement des différents métaux et alliages en fonction de ce potentiel mesuré.
Lors d’un couplage entre deux métaux ou alliages différents, il va s’établir un courant électronique entre eux résultant du court-circuit formé. On observe généralement un accroissement de la corrosion de l’alliage le moins noble et diminution ou suppression de la corrosion de l’alliage le plus noble.
La différence de potentiel indique le sens de la menace, mais pas son ampleur. Ce n’est donc pas le seul facteur à prendre en compte. La conduction électrique du milieu, la température sont aussi des facteurs importants.
Pour avoir une corrosion galvanique, trois conditions sont nécessaires :
- des métaux de nature différente : c’est la différence de potentiel de dissolution entre les deux métaux qui provoque le phénomène. L’expérience montre qu’il faut une différence de potentiel de 100 mV pour voir apparaître la corrosion.
- la présence d’un électrolyte, en général aqueux : la présence d’ions dans le milieu aqueux (ex. : eau de mer), accélère le phénomène. Ce type de corrosion peut également exister dans un milieu anhydre mais ionique comme l’ammoniaque liquide.
- la continuité électrique entre les deux métaux : le phénomène diminue très rapidement en éloignant les deux métaux. Il faut qu’il y ait transfert de charges électriques pour avoir le phénomène de corrosion.
En fonction des modifications de l’électrolyte, on peut avoir des inversions dans la série des potentiels. Le zinc, par exemple, recouvert de produits de corrosion, peut devenir plus « noble » que le fer dans certaines eaux chaudes. L’étain peut devenir moins « noble » que le fer dans les solutions d’acide organique (problème des conserves alimentaires).
Pour un courant donné entre deux métaux différents, la densité du courant et, par suite, la vitesse de dissolution du métal le moins noble (anode) sera d’autant plus élevée que cette anode sera de petite surface.
Quelques moyens de lutte contre cette corrosion : choisir des couples métalliques dont les éléments sont le plus proches possible dans la série galvanique correspondante, éviter un rapport de surface défavorable, éviter dans la mesure du possible, à l’aide d’un joint, d’un isolant, d’un revêtement, … le contact direct de deux métaux différents, etc.
En fonction des utilisations ou des environnements de fonctionnement indiqués par ses clients Filame peut proposer des choix de matériaux ou des choix de traitement de surface pour éviter ou diminuer le phénomène de corrosion galvanique. Filame recommande à ses clients de toujours bien indiquer lors de leur demande de devis ces différents éléments.